
Acid Base Theory - Pharmaceutical Inorganic Chemistry B. Pharma 1st Semester
యాసిడ్ బేస్ సిద్ధాంతం
కంటెంట్లు
సిద్ధాంతాలు:
• ఆమ్లాలు
• స్థావరాలు మరియు
• లవణాలు
శిక్షణ లక్ష్యాలు
ఈ ఉపన్యాసం ముగింపులో, విద్యార్థి వీటిని చేయగలరు:
వర్గీకరించండి:
• ఆమ్లాలు
• స్థావరాలు మరియు
• వివిధ సిద్ధాంతాల ఆధారంగా లవణాలు
ఆమ్లాలు మరియు క్షారాల చరిత్ర
కెమిస్ట్రీ ప్రారంభ రోజులలో రసాయన శాస్త్రవేత్తలు పదార్థాల భౌతిక మరియు రసాయన లక్షణాలను నిర్వహించేవారు. అనేక పదార్ధాలను రెండు వేర్వేరు ఆస్తి వర్గాలలో ఉంచవచ్చని వారు కనుగొన్నారు:
పదార్ధం A | పదార్థం బి |
1. పుల్లని రుచి | 1. చేదు రుచి |
2. CO2 చేయడానికి కార్బోనేట్లతో చర్య జరుపుతుంది | 2. సబ్బులను తయారు చేయడానికి కొవ్వులతో చర్య జరుపుతుంది |
3. H2ను ఉత్పత్తి చేయడానికి లోహాలతో చర్య జరుపుతుంది | 3. లోహాలతో చర్య తీసుకోవద్దు |
4. నీలం లిట్మస్ గులాబీ రంగులోకి మారుతుంది | 4. ఎరుపు లిట్మస్ నీలం రంగులోకి మారుతుంది |
5. ఉప్పు మరియు నీటిని తయారు చేయడానికి B పదార్థాలతో చర్య జరుపుతుంది | 5. ఉప్పు మరియు నీటిని తయారు చేయడానికి A పదార్ధాలతో చర్య జరుపుతుంది |
6. pH <7 | 6. pH >7 |
నీటిలో వాటి అయనీకరణం కారణంగా పదార్థాలు A లేదా Bలో ఎందుకు ఉంటాయో కారణాన్ని సూచించిన మొదటి వ్యక్తి అర్హేనియస్ .
అర్హేనియస్ సిద్ధాంతం
స్వీడిష్ రసాయన శాస్త్రవేత్త Svante Arrhenius ఆమ్లాలు మరియు క్షారాలకు మొదటి నిర్వచనాన్ని ప్రతిపాదించాడు (1887)
అర్హేనియస్ మోడల్ ప్రకారం:
"ఆమ్లాలు H + అయాన్లను ఉత్పత్తి చేయడానికి నీటిలో విడదీసే పదార్థాలు మరియు బేస్లు OH - అయాన్లను ఉత్పత్తి చేయడానికి నీటిలో విడదీసే పదార్థాలు"
NaOH (aq) నుండి Na + (aq) + OH - (aq) బేస్
HCl(aq) నుండి H + ( aq)+Cl- ( aq) యాసిడ్
అర్హేనియస్ సిద్ధాంతం: తటస్థీకరణ ప్రతిచర్యలు
• అర్హేనియస్ ఆమ్లాలు మరియు ధాతువులు ఒకదానితో ఒకటి చర్య జరిపి తటస్థీకరణ చర్యల్లో నీరు మరియు సజల లవణాలను ఏర్పరుస్తాయి.
H + (aq) + A - (aq) + M + (aq) + OH - (aq) నుండి H 2 O (l) + M + (aq) + A - (aq)
• నికర అయానిక్ సమీకరణం
H + (aq) + OH - (aq) à H 2 O (l)
అర్హేనియస్ భావన ఆధారంగా యాసిడ్ మరియు బేస్ వర్గీకరణ:
ఆమ్లము | బేస్ |
బలమైన ఆమ్లం | బలమైన పునాది |
బలహీన ఆమ్లం | బలహీనమైన పునాది |
మోనో బేసిక్ యాసిడ్ | మోనో యాసిడిక్ బేస్ |
డైబాసిక్ యాసిడ్ | ఆమ్ల ఆధారం |
ట్రైబాసిక్ యాసిడ్ | ట్రైబాసిక్ బేస్ |
అర్హేనియస్ భావన యొక్క పరిమితులు
• నిర్వచనాలు సజల ద్రావణం పరంగా మాత్రమే ఉంటాయి మరియు పదార్ధం పరంగా కాదు
• సజల రహిత ద్రావకాలలోని పదార్థాల యొక్క ఆమ్ల మరియు ప్రాథమిక లక్షణాలను సిద్ధాంతం వివరించలేకపోయింది
ఉదాహరణ: ద్రవ అమ్మోనియాలోని అమ్మోనియం నైట్రేట్ H + అయాన్లను ఇవ్వనప్పటికీ ఆమ్లంగా పనిచేస్తుంది
• OH - అయాన్లు లేని అమ్మోనియా లేదా సోడియం కార్బోనేట్ వంటి పదార్థాల ప్రాథమిక స్వభావం ఈ భావన ద్వారా వివరించబడలేదు
• H + అయాన్లు లేని కార్బన్ డై ఆక్సైడ్, సల్ఫర్ డై ఆక్సైడ్ యొక్క ఆమ్ల స్వభావం ఈ భావన ద్వారా వివరించబడలేదు
• ద్రావకం లేనప్పుడు యాసిడ్ మరియు బేస్ యొక్క తటస్థీకరణ వివరించబడలేదు
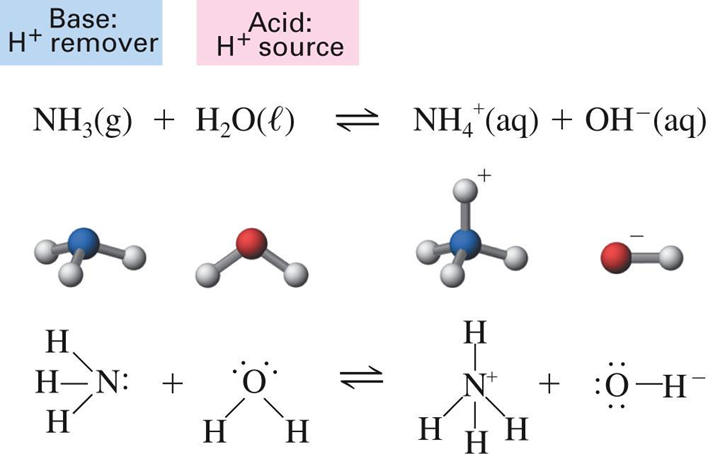
బ్రోన్స్టెడ్ లోరీ థియరీ (1923)
జోహన్నెస్ బ్రోన్స్టెడ్ మరియు థామస్ లోరీ ఈ ప్రవర్తనను చేర్చడానికి అర్హేనియస్ యొక్క యాసిడ్-బేస్ సిద్ధాంతాన్ని సవరించారు. వారు ఈ క్రింది విధంగా ఆమ్లాలు మరియు క్షారాలను నిర్వచించారు:
"యాసిడ్ అనేది ప్రోటాన్ను దానం చేసే హైడ్రోజన్ కలిగిన జాతులు. ప్రోటాన్ను అంగీకరించే ఏదైనా పదార్ధం బేస్"
HCl (aq) + H 2 O (l) à Cl - (aq) + H 3 O + (aq)
పై ఉదాహరణలో బ్రొన్స్టెడ్ ఆమ్లం అంటే ఏమిటి? బ్రోన్స్టెడ్ బేస్ అంటే ఏమిటి?
వాస్తవానికి, H 2 O తో HCl యొక్క ప్రతిచర్య ఒక సమతౌల్యం మరియు రెండు దిశలలో సంభవిస్తుంది, అయితే ఈ సందర్భంలో సమతౌల్యం చాలా కుడి వైపున ఉంటుంది.
HCl (aq) + H2O (l) à Cl - ( aq) + H 3 O + (aq)
రివర్స్ రియాక్షన్ కోసం Cl - బ్రాంస్టెడ్ బేస్గా ప్రవర్తిస్తుంది మరియు H 3 O + బ్రోన్స్టెడ్ యాసిడ్గా ప్రవర్తిస్తుంది .
Cl-ని HCl యొక్క కంజుగేట్ బేస్ అంటారు. బ్రోన్స్టెడ్ ఆమ్లాలు మరియు క్షారాలు ఎల్లప్పుడూ సంయోగ యాసిడ్-బేస్ జంటలుగా ఉంటాయి .
బ్రోన్స్టెడ్-లోరీ థియరీ ఆఫ్ యాసిడ్స్ & బేస్లు యాసిడ్-బేస్ పెయిర్స్ సంయోగం
సాధారణ సమీకరణం
బ్రోన్స్టెడ్-లోరీ థియరీ ఆఫ్ యాసిడ్స్ & బేసెస్: ఉదాహరణ
నీరు యాసిడ్ & బేస్ = యాంఫోటెరిక్ రెండూ అని గమనించండి
బ్రోన్స్టెడ్-లోరీ థియరీ ఆఫ్ యాసిడ్స్ & బేసెస్ ప్రోటాన్ బదిలీ ప్రతిచర్యలు
• సమ్మేళనాల జతల బ్రోన్స్టెడ్-లోరీ యాసిడ్-బేస్ రియాక్షన్ల ద్వారా ఒకదానికొకటి సంబంధం కలిగి ఉంటాయి. ఇవి సంయోగ యాసిడ్-బేస్ జతలు.
• సాధారణంగా, యాసిడ్ HA ఒక సంయోగ స్థావరాన్ని కలిగి ఉంటుంది - (యాసిడ్ నుండి దూరంగా బదిలీ చేయబడిన ప్రోటాన్). దీనికి విరుద్ధంగా, ఒక బేస్ B సంయోగ యాసిడ్ BH + (ఒక ప్రోటాన్ బేస్ వైపు బదిలీ చేయబడింది) కలిగి ఉంటుంది.
వర్గీకరణ:
బ్రోన్స్టెడ్ యాసిడ్:
మోనో ప్రోటిక్ యాసిడ్: ఒక ప్రోటాన్ మాత్రమే దానం చేయగల సామర్థ్యం
ఉదాహరణ: HF, CH3COOH
పాలీ ప్రోటిక్ యాసిడ్: ఒకటి కంటే ఎక్కువ ప్రోటాన్లను దానం చేయగల సామర్థ్యం
ఉదాహరణ: H2S, H2O
బ్రోన్స్టెడ్ బేస్:
మోనో ప్రోటిక్ బేస్: ఇది ఒక ప్రోటాన్ని అంగీకరించగలదు
ఉదాహరణ: నీరు
పాలీ ప్రోటిక్ బేస్: ఇది రెండు లేదా అంతకంటే ఎక్కువ ప్రోటాన్లను అంగీకరించగలదు
ఉదాహరణ: సల్ఫేట్ అయాన్, ఫాస్ఫేట్ అయాన్
లూయిస్ ఆమ్లాలు మరియు స్థావరాలు
గిల్బర్ట్ న్యూటన్ లూయిస్ (1875-1946) ప్రభావవంతమైన అమెరికన్ రసాయన శాస్త్రవేత్త. అతని సిద్ధాంతాలలో Chem120లో బోధించబడిన లూయిస్ డాట్ నిర్మాణం మరియు సమయోజనీయ బంధ సిద్ధాంతాలు ఉన్నాయి.
లూయిస్ ఆమ్లాలు ఎలక్ట్రోఫిల్స్: H+, Na+, BF3,
లూయిస్ స్థావరాలు న్యూక్లియోఫిల్స్: NH3, H2O, PH3
యాసిడ్ బేస్ ప్రతిచర్యలు:
BF3 + :NH3 à F3B:NH3
లూయిస్ ఆమ్లాలు మరియు స్థావరాలు
సాధారణంగా LA + :LB à LA-LB
లక్స్ వరద సిద్ధాంతం
• ఇది ఆక్సైడ్ వ్యవస్థకు మాత్రమే వర్తిస్తుంది
ఈ సిద్ధాంతం ప్రకారం:
• బేస్ అనేది ఆక్సైడ్ అయాన్ దాత మరియు
• యాసిడ్ అనేది ఆక్సైడ్ అయాన్ స్వీకర్త
ఉదాహరణ: CaO + SiO 2 → CaSiO 3
యురాన్వోనిష్ సిద్ధాంతం
ఈ సిద్ధాంతాన్ని రష్యన్ రసాయన శాస్త్రవేత్త అందించారు: యురాన్వోనిష్ 1939లో
• యాసిడ్ అనేది కేషన్ను వదులుకోవడానికి బేస్తో చర్య జరిపే పదార్ధం
• బేస్ అనేది అయాన్ను వదిలివేసే ఆమ్లంతో చర్య జరిపి కేషన్ లేదా ఎలక్ట్రాన్ను అంగీకరించే పదార్ధం
ఉదాహరణ: SO 3 -- + Na 2 O → Na 2 SO 4
సారాంశం
ఆమ్లాలు:
• ఆమ్లాలు పుల్లని రుచిని కలిగి ఉంటాయి
• అర్హేనియస్ యాసిడ్: నీటిలో కరిగినప్పుడు హైడ్రోనియం అయాన్ (H3O + ) గాఢతను పెంచే ఏదైనా పదార్ధం
• బ్రోన్స్టెడ్-లోరీ యాసిడ్: ప్రోటాన్ దాత
• లూయిస్ యాసిడ్: ఎలక్ట్రాన్ అంగీకారకం
స్థావరాలు:
• బేస్ చేదు రుచి మరియు జారే
• అర్హేనియస్ బేస్: నీటిలో కరిగినప్పుడు హైడ్రాక్సైడ్ అయాన్ (OH - ) గాఢతను పెంచే ఏదైనా పదార్ధం
• బ్రోన్స్టెడ్-లోరీ బేస్: ప్రోటాన్ యాక్సెప్టర్
• లూయిస్ యాసిడ్: ఎలక్ట్రాన్ దాత











0 Comments: